脂质纳米颗粒(LNP)在合理设计和筛选方法上的研究取得了诸多成果,其核酸递送效率和安全性已在研究人员不断努力下提高了几个数量级。除了运用于递送小干扰RNA(siRNA)药物和传染病mRNA疫苗,未来还有望在癌症免疫治疗mRNA疫苗,过继细胞疗法的体内外工程化递送以及CRISPR基因编辑中发挥重要作用。
尽管基于LNP-mRNA的疗法已取得了临床成功,但LNPs如何介导mRNA从内体释放到细胞质中的机制仍未被完全研究透彻。LNP的循环动力学,生物分布,特异性靶向性和细胞摄取可以通过修饰优化表面特性实现,而普遍认为,可电离脂质成分(CIL)的结构转变和pH依赖性反应机制是内体释放的关键。目前大部分研究局限于空载LNP的内体逃逸而忽视了mRNA与CIL响应内体pH变化后的整体结构转变和释放。
2023年12月6日,来自阿斯利康的研发团队在期刊PNAS上在线发表了题为“pH-dependent structural transitions in cationic ionizable lipid mesophases are critical for lipid nanoparticle function”的研究论文。本研究系统对比了不同可电离脂质的pH依赖性结构转变,并通过分子动力学模拟揭示结构转变差异对mRNA内体逃逸释放的不同影响。

CIL/Chol表现出随pH改变而变化的溶致相(Lyotropic Phase)
![]() 为了解LNPs核心的结构转变,研究人员研究了CIL/chol/缓冲液在有或没有核酸载物情况下宏观本体相(Macroscopic bulk phases)随pH的变化,并采用高分辨率同步辐射SAXS的数据进行分析。单磷酸腺苷均聚物poly(A)因其相似的生物物理特性而被选为mRNA的替代模型,并且研究使用的混合物尽可能模拟LNP-mRNA药物的制备生产过程。
为了解LNPs核心的结构转变,研究人员研究了CIL/chol/缓冲液在有或没有核酸载物情况下宏观本体相(Macroscopic bulk phases)随pH的变化,并采用高分辨率同步辐射SAXS的数据进行分析。单磷酸腺苷均聚物poly(A)因其相似的生物物理特性而被选为mRNA的替代模型,并且研究使用的混合物尽可能模拟LNP-mRNA药物的制备生产过程。
图1A中展示了三种CIL(MC3、KC2和DD)在一系列pH条件下透析的CIL/chol/缓冲液本体相的散射数据,根据相对峰位置识别有序相的晶体对称性(图1C)。
所有三个CIL/chol/缓冲相的结构总体进展趋势如下:
1)在中性pH值下,本体相为无序的反胶束LII相,具有一个主结构峰(在0.1 Å−1处)和约0.2 Å−1处的二阶弱峰;
2)当pH值约为6.0至6.5时,出现各向同性的立方形反胶束相(Fd3m),随后转变为反六方形HII相。
DD/chol/缓冲液在pH值低于5的极低pH下,会出现额外的双连续立方形相(Pn0m)。极少数情况下,pH值为7时,会出现P6(3)/mmc六方晶体结构相。根据图1A,还观察到CIL整体序列的中间相遵循溶致液晶相形成过程中由分子形状因子驱动的行为,也被称为CPP(critical packing parameter):在中性pH值下,CIL单层具有负曲率并趋向于形成反胶束结构。增加CIL头基的质子化程度(随pH降低而增加)会同时增加头基面积,继而使得结构曲率自发向更小值的负曲率变化,最终接近零曲率。
这些结果表明,三种CIL/chol/缓冲液混合物的脂质本体相显示出几乎相同的中间相序,其结构趋势随着pH值的降低而从负曲率到零曲率转变。
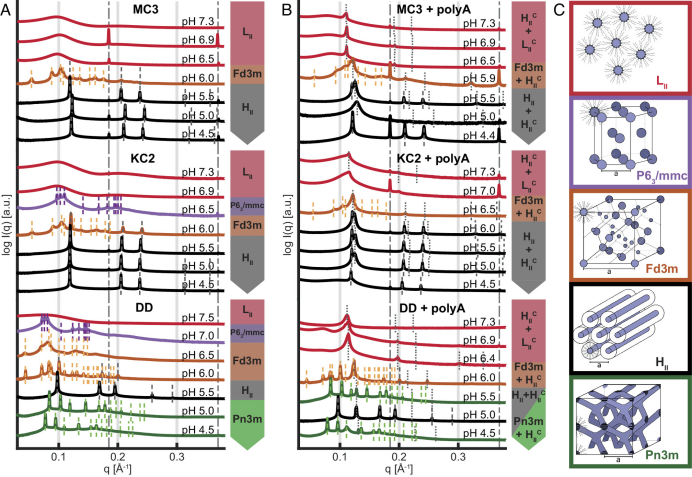
图1. 基于SAXS的pH依赖性中间相转变鉴定
Poly(A)络合CIL与过量CIL共存
![]() 将poly(A)添加到CIL/chol/缓冲相中后,可在SAXS数据中观察到与络合相相对应的额外峰。额外的峰出现在未添加poly(A)的相的上方,因此显示过量的CIL相与polyA-CIL络合相共存。在pH值5.5至6.5范围中观察到两个紧密间隔的一阶序反射,证实反六方相和反脂质相共存。当pH值高于6.5时,有序相转变为无序的LII相,同时络合的反六方相继续存在,峰值高于LII。
将poly(A)添加到CIL/chol/缓冲相中后,可在SAXS数据中观察到与络合相相对应的额外峰。额外的峰出现在未添加poly(A)的相的上方,因此显示过量的CIL相与polyA-CIL络合相共存。在pH值5.5至6.5范围中观察到两个紧密间隔的一阶序反射,证实反六方相和反脂质相共存。当pH值高于6.5时,有序相转变为无序的LII相,同时络合的反六方相继续存在,峰值高于LII。
在此过程中,没有发现上清液中核酸含量的增加,证明poly(A)没有随pH增加从本体相中释放。因此研究人员推测,HcII的反六方胶束分散成poly(A)填充的反圆柱形胶束LcII,并溶解在过量的胶束脂质相中。这种平衡相在很长一段时间内保持稳定,SAXS长时间内没有显示多个相共存的迹象。
将poly(A)添加到CIL/chol/缓冲液系统中会导致poly(A)和CIL络合,出现额外的反六方缩合相HcII。在高pH值如6到7时,则形成分散的反圆柱形胶束LcII相。
LNP-mRNA仍显示pH依赖性结构变化特征
![]() 接下来,研究人员直接比较了CIL+poly(A)与CIL+mRNA和LNP+mRNA在pH 5和pH 7下的SAXS散射曲线(图2A)。mRNA替换poly(A)后,并未出现与前阶段实验中观察到的络合状态HcII相相似的峰。这一发现可能是由于mRNA的二级结构与长程反六方序结构不兼容。当比较CIL-mRNA本体相与100 nm大小的mRNA-LNP的散射时,观察到实际空间间距增加。研究人员推测可能是尺寸效应降低了反六方相的长程阶数,LNP核心相组成可能与重构的CIL本体相略有不同,但整体上表现出非常相似的散射数据。
接下来,研究人员直接比较了CIL+poly(A)与CIL+mRNA和LNP+mRNA在pH 5和pH 7下的SAXS散射曲线(图2A)。mRNA替换poly(A)后,并未出现与前阶段实验中观察到的络合状态HcII相相似的峰。这一发现可能是由于mRNA的二级结构与长程反六方序结构不兼容。当比较CIL-mRNA本体相与100 nm大小的mRNA-LNP的散射时,观察到实际空间间距增加。研究人员推测可能是尺寸效应降低了反六方相的长程阶数,LNP核心相组成可能与重构的CIL本体相略有不同,但整体上表现出非常相似的散射数据。
这一结果表明,在LNP核心相中也存在CIL随高pH值的无序LII相向低pH值的有序HII相的转变。在图2B中展现了过渡过程中的排列情况。圆柱形CIL结构将覆盖保留二级结构的mRNA轮廓,并表现为LcII。
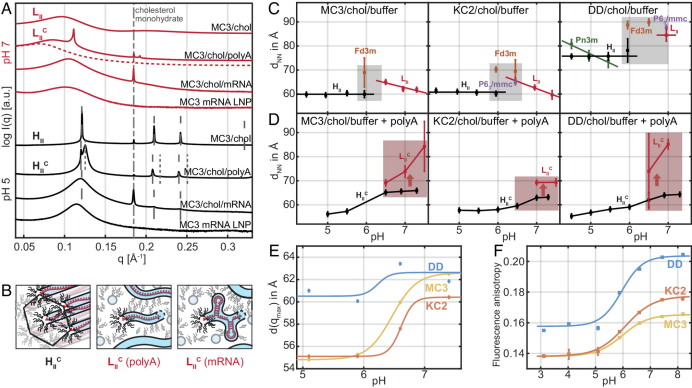
图2. CIL与LNP核心相的散射特征和pH诱导的转变
pH诱导的CIL和LNP结构转变与转染效率差异
![]() 在图2C中可以观察到,MC3和KC2表现出非常相似的趋势和间距。反胶束相LII中的最近邻距离随着pH值的降低而增加。这可以解释为可电离脂质头基的质子化,伴随着胶束的吸水和溶胀。随着尺寸的增加,堆积排列的程度增加,最终在pH值约为6.5时形成立方液晶相。在该pH值下,几乎总可以观察到反六方HII相共存。
在图2C中可以观察到,MC3和KC2表现出非常相似的趋势和间距。反胶束相LII中的最近邻距离随着pH值的降低而增加。这可以解释为可电离脂质头基的质子化,伴随着胶束的吸水和溶胀。随着尺寸的增加,堆积排列的程度增加,最终在pH值约为6.5时形成立方液晶相。在该pH值下,几乎总可以观察到反六方HII相共存。
研究人员还发现,MC3和KC2的最近邻间距不会随着pH值的进一步降低而改变。相比之下,DD的最近邻间距更大。DD具有双连续立方相与HII共存的特点,并随pH值降低,最近邻间距逐渐膨胀,较慢形成类似MC3和KC2的圆柱形LII相并进一步发生转变。
在此基础上,研究人员采用Cy5标记mRNA的荧光和LNP转染后eGFP表达的荧光进行转染效率的比较,并监测内体融合事件发生的时间点。MC3和KC2表现出相似的Cy5与eGFP信号起始时间,而DD的Cy5和eGFP起始都相对延迟,因此,以DD作为CIL组分的LNP介导的eGFP初始表达率较低,表现出延迟的转染和表达动力学。MD模拟表明,过量的脂质结构部分至少在局部有利于形成反球面胶束的几何形状,并且经历反球面到圆柱形的拓扑转变。这种机制可能促进LNP与内体膜的融合。
此外,研究人员还提出,“内体膜融合”和“mRNA释放”应该被看作两个不同且有一定延迟的过程。两种荧光的前后时间差证明,内体膜融合后不会立即导致mRNA释放并进行翻译,但这种延迟尚不清楚是否受mRNA-CIL静电作用的影响。最新的SAXS数据表明,蛋白吸附诱导的构象变化确实会影响LNP的核心结构,反之亦然。表面-核心的相互关系意味着pH诱导的LNP核心结构相变也将影响表面组成的构象变化。
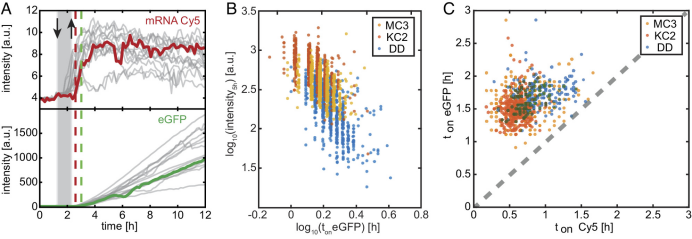
图3. 体外eGFP-mRNA LNP转染后的表达动力学
总结
![]() 虽然大多数文献都试图引出结构-活性关系,本文章表明结构相变也可能对转染活性产生影响。类似的pH依赖性结构转变可能也存在于其他用于mRNA递送的优化可电离脂质中,如ALC-0315和SM-102等,仍需要更深入的对比研究。研究CIL结构转变的影响因素、分子动力学以及对内体膜融合和核酸载物释放的影响将有助于合理设计mRNA-LNP制剂,使其未来能用于更广泛的医学应用领域。
虽然大多数文献都试图引出结构-活性关系,本文章表明结构相变也可能对转染活性产生影响。类似的pH依赖性结构转变可能也存在于其他用于mRNA递送的优化可电离脂质中,如ALC-0315和SM-102等,仍需要更深入的对比研究。研究CIL结构转变的影响因素、分子动力学以及对内体膜融合和核酸载物释放的影响将有助于合理设计mRNA-LNP制剂,使其未来能用于更广泛的医学应用领域。
参考资料
R, Brummer C, et.al., pH-dependent structural transitions in cationic ionizable lipid mesophases are critical for lipid nanoparticle function. Proc Natl Acad Sci U S A. 2023 Dec 12;120(50):e2310491120. doi: 10.1073/pnas.2310491120.
来源:颗粒之窗













